 ALIMENTAZIONE
ALIMENTAZIONE
DIMAGRIMENTO
a cura di Orazio
Paternò
 ALIMENTAZIONE ALIMENTAZIONE
DIMAGRIMENTO
a cura di Orazio
Paternò
|
| CHI SONO | RAGIONI DEL SITO | TUTTI GLI ARTICOLI | CONTATTI |
| EPIGENETICA
E SALUTE CATTIVE ABITUDINI IN EREDITÀ  Anche
se ci si arrampica a fatica tra istoni,
base azotate, genotipo e fenotipo vale la pena smarcarsi
per qualche minuto da questa penombra culturale e affacciarsi
sull’EPIGENETICA,
nuova frontiera
della ricerca genetica che sta ridefinendo i confini degli
effetti delle cattive abitudini: il matrimonio col divano, il fumo,
l’alcol e i cedimenti cronici alla forchetta (per restare nel
nostro ambito) potrebbe farsi sentire ben oltre la portata di una
generazione. Sarà dunque utile un doppio sopralluogo nella
nostra coscienza perché ciò che facciamo oggi
potrebbe travalicare i danni alla sola nostra salute, condizionando
anche quella dei nostri figli e dei nostri nipoti.
BREVIARIO
DI EPIGENETICA
L’EPIGENETICA è uno dei contrafforti della ricerca biomedica ed evolutiva moderna. Tecnicamente siamo di fronte a “cambiamenti ereditabili nella espressione del gene non attribuibili a una variazione della sequenza nucleotidica”. Stiamo parlando, pare quasi incredibile, dell’effetto ambientale (non mutageno) sul DNA e le conseguenti modificazioni della sintesi proteica: lo stile di vita, insomma, non muta il DNA, ma può “sbianchettare” o “evidenziare” le sue pagine più critiche, quelle legate all’espressione di malattie come il diabete di tipo II, tumori, malattie cardiovascolari e disordini mentali quando non sono legate all’eredità di tipi mendeliano, a mutazioni del DNA o a danni genetici. Con l’epigenetica il DNA non subisce mutazioni (epigenetica, etimologicamente, significa “sopra la genetica”, cioè al di sopra di variazioni mutazionali del DNA), ma in seguito a influenze ambientali si realizzano un’alterazione, una correzione, uno spegnimento o una ripetizione delle istruzioni che ci consentono di montare una proteina. Si parla di alterazioni epigenetiche o epimutazioni (Prog Biophys Mol Biol. 2015) e la linea germinale maschile e/o femminile sono ambasciatori di questi messaggi ai discendenti. L’idea che l’esposizione di genitori e progenitori a certi fattori ambientali portasse in eredità dei discendenti determinate caratteristiche fisiche (dette fenotipiche) e il rischio di sviluppare certe malattie ha affascinato molti scienziati per decenni (Nelson and Nadeau, 2010, Pembrey, 2010 and Soubry et al., 2014). Già degli studi osservazionali negli anni ‘30 e ‘70 del secolo scorso avevano inoculato la suggestione di un ruolo paterno in questo processo transgenerazionale (Fabia and Thuy, 1974 and Price, 1939) Chi presidia questa complicata operazione di modifica dell’espressione del DNA? Gli ISTONI, proteine che si arrotolano come cilindretti attorno a tratti del DNA “attaccandogli” un gruppo metile, una molecola che interferisce con la lettura di quel frammento di DNA. Non mutazioni vere e proprie dunque, ma aggiunte di gruppi metilici ad alcuni tratti del DNA. Qui trovate un bel video esplicativo del processo di metilazione del DNA: https://www.youtube.com/watch?v=29doT6Hf2MI  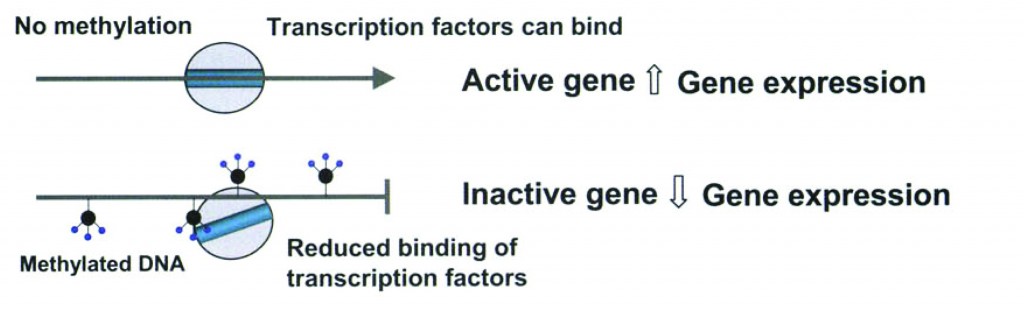 Come risultato avremo delle proteine in decine di varianti e che consentono agli esseri viventi di adattarsi all’ambiente in modo plastico e veloce. Le proteine vengono inattivate o funzionano diversamente, molte proteine non vengono più espresse del tutto: un solo spartito, il DNA, per tanti interpreti diversi, le proteine (fenotipi). È IL CASO TIPICO DEI GEMELLI OMOZIGOTI che partono dallo stesso DNA ma che esibiscono piccole, magari impercettibili differenze. Cosa ha avuto un ruolo determinante nel modulare la lettura dello stesso spartito (DNA) per produrre delle differenze più o meno pronunciate (fenotipo) nei due organismi interpreti? I FATTORI AMBIENTALI. Quegli stessi fattori ambientali che diventano decisivi, per esempio, nello sviluppare in tutte le sue potenzialità l’INSULINORESISTENZA (anticamera del diabete) nei bambini sedentari. DALLA
SEDENTARIETÀ AL FUMO
 Quando si tratta di fumo, filtra sempre un refolo di malinconia perché non se ne può che parlare male. Anche in termini epigenetici. Padri fumatori sembrano generare figli maschi sovrappeso già a 9 anni di età. Più precoce è l’età in cui i padri iniziano a fumare (< 11 anni) più grasso sarà il figlio entro i 9 anni. L’influenza negativa del tabagismo giovanile paterno sul peso corporeo non coinvolge, però, le figlie femmine (Pembrey et al., 2010). Inoltre il fumo sembra indurre la metilazione di alcuni geni che svolgono attività di soppressione delle cellule neoplastiche. Alla luce di questa evidenza, IL FUMATORE È ESPOSTO A UN RISCHIO DOPPIO: 1. diretto a causa delle molecole tumorali sviluppate dalla combustione del tabacco 2. indiretto a causa della soppressione dei geni che regolano le attività tumorali. Sono in atto studi per accertare se tali modificazioni siano ereditabili. Se fosse vero, neonati figli di fumatori avrebbero maggiori probabilità di sviluppare tumori, anche senza avere mai fumato in vita loro (Bishop et al., Mutation Research). DAL FUMO ALLE CARESTIE  In uno studio del 2006 (Overkalix Study) nel quale si passava alla lente di ingrandimento una popolazione di un remoto paese svedese (Overkalix, appunto) si osservò che la disponibilità alimentare dei nonni condizionava il tasso di mortalità nelle due generazioni successive in maniera sesso-specifica: le abitudini alimentari del nonno influenzava il metabolismo del nipote, quello della nonna lasciava la firma sul metabolismo della nipote. È risultato di estremo interesse come fosse l’età del nonno/a in cui si affermava lo stress alimentare –ipernutrizione o iponutrizione – a condizionare l’esito protettivo o distruttivo sulla salute dei nipoti. Per esempio, una carestia tra i 9 e i 13 anni era correlata a una diminuzione del rischio di mortalità nei nipoti, mentre lo stesso tipo di stress alimentare (denutrizione) subito tra i 18 e i 22 anni era associato a un incremento del rischio mortalità nei nipoti (Cell, 2015) Pembrey e colleghi hanno osservato che nipoti maschi di uomini svedesi che nel IXX secolo sono stati esposti a eccessi di cibo durante la fase lenta della crescita (9-12 anni nei maschi, 8-10 anni nelle femmine- quando i fattori ambientali hanno una grande influenza sull’organismo), si ammalavano significativamente PIÙ di patologie cardiovascolari e di diabete di tipo II (Kaati et al., 2002). Viceversa, i nipoti maschi erano meno esposti a diabete di tipo II e malattie cardiovascolari se i nonni avevano patito una carestia nella prepubertà. Il rischio di mortalità penalizzava o premiava figli e nipoti in rapporto alla disponibilità di cibo dei padri o dei nonni nella sensibile fase della prepubertà, durante la quale si assiste a una trasformazione delle cellule spermatiche dell’individuo da cellule germinali primordiali (PGCs) a spermatogoni. Le informazioni ambientali registrate in questo periodo possono essere “immagazzinate” e trasmesse alle generazioni successive. Genitori e nonni paterni che hanno cronicamente patito la fame durante le due Guerre Mondiali sembra abbiano generato figli e nipoti più protetti da malattie cardiovascolari e diabete anche se questi mangiavano molto (Pembrey et al.). In seguito a carestia cronica e duratura l’organismo migliora la sua risposta glicemica grazie ad una modificazione a feedback dei geni preposti alla gestione del carico glicemico. L’effetto opposto veniva osservato in individui nati in condizioni di SURPLUS ALIMENTARE: se i nonni avevano vissuto nell’abbondanza, i nipoti erano statisticamente più esposti al diabete di tipo II. NON TUTTI GLI STUDI CONCORDANO SUGLI EFFETTI EPIGENETICI DELLA CARESTIA. La prestigiosa rivista Cell, nel 2015, riportava un celebre esempio di come la disponibilità di cibo durante la gravidanza possa influenzare la salute dei figli anche a distanza di anni. Lo spunto ha preso l’abbrivio dal Dutch Hunger Winter Study che ha valutato gli effetti della carestia occorsa nella parte occidentale dell’Olanda durante la guerra, negli anni 1944-45. Il periodo della carestia era ben definito e le razioni di cibo ben documentate. Si sono conservati fino a oggi i registri relativi alle condizioni di salute e al peso dei neonati. Numerosi studi su questa popolazione hanno dimostrato chiaramente che l’esposizione prenatale alla carestia è associata con uno sviluppo tardivo di obesità, diabete e malattie cardiovascolari David Baker e Nicholas Hales hanno coniato l’espressione origine fetale della malattia adulta dopo che nei loro studi hanno dimostrato una relazione tra il basso peso alla nascita e il futuro sviluppo di malattie cardiovascolari e uno squilibrio nella tolleranza al glucosio (The thrifty phenotype hypothesis, Br. Med. Bull., 2001) OBESITÀ,
EPIGENETICA E IL RUOLO DEL PADRE:
 Alcuni studi puntano più sulla trasmissione paterna dei tratti epigenetici per una modificazione dei gameti maschili (Pembrey et al., 2010). L’eredità epigenetica attraverso i gameti coinvolge tre attori: 1. la metilazione del DNA (metilazione della citosina) 2. la trascrizione di RNAs non-codificante (Jenkins and Carrell, 2011) 3. il rimodellamento della cromatina. L’IMPRINTING GENETICO DEI GAMETI, cioè la metilazione e inattivazione del DNA degli spermatozoi, è evidente quando parliamo di OBESITÀ (Ann Nutr Metab. 2014). Diversi studi oramai indicano che l’alimentazione è in grado di indurre mutamenti epigenetici attraverso la linea germinale maschile. Questi cambiamenti possono essere trasferiti all’embrione, inducendo perturbazioni fenotipiche o metaboliche nella prole. In alcuni casi tali alterazioni si tramandano per generazioni. Come vedremo più avanti, però, anche la madre può ricoprire un ruolo nella trasmissione epigenetica dell’obesità. 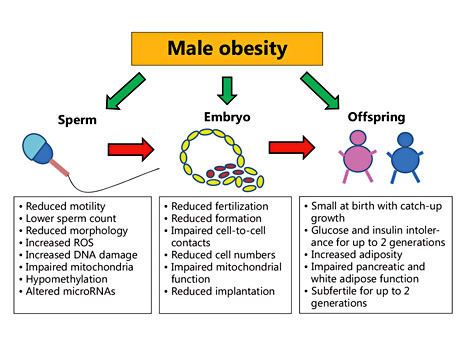 Studi sui topi (Binder et al., 2012) avevano già mostrato una crescita irregolare della placenta e del feto quando i padri venivano resi obesi. Ma nove settimane di dieta ed esercizio fisico nel periodo pre-concepimento avevano restituito regolarità alla crescita embrionale e fetale (McPherson et al., 2013). Topi maschi che hanno vissuto uno stress lasciano un’impronta epigenetica sui propri spermatozoi generando figli con una risposta allo stress più intensa del normale (Proceedings of the National Academy of Sciences, 2015) Negli ultimi 5 anni un numero crescente di studi sugli animali ha concluso che l’esposizione a esordio precoce a fattori dietetici o inquinanti ( 2014) può influenzare la gametogenesi maschile producendo una prole più o meno esposta a malattie. Altre forme di modificazioni epigenetiche tramandate ai figli includono le interazioni e i comportamenti sociali, lo stress e altre avversità di carattere psicologico (Soubry et al.,Gapp et al., 2014; Rodgers et al., 2013, Szyf, 2013a and Szyf, 2013b). Sugli umani una serie di studi ha trovato un legame tra l’obesità paterna e la crescita irregolare del feto (Bakos et al.; 2011a and Petersen et al., 2013; Chen et al., 2012; Anifandis et al., 2013 and Bellver, 2013)  OBESITÀ
PRECOCE: LE RICADUTE SUI FIGLI
Nel celebre Framingham Heart Study
è stata osservata un’associazione
tra l’obesità paterna a esordio precoce ed elevati
livelli sierici di alanina amino transferasi (ALT)
nei figli. Alti livelli di questa molecola predicono
l’insorgenza di possibili disordini metabolici. Cosa
interessante è che l’insorgenza tardiva
dell’obesità nel padre e nella madre non hanno
procurato un aumento di ALT nei figli (Loomba et al., 2008).L’obesità umana è il risultato di interazioni complesse tra un background genetico e fattori ambientali (Bouchard, 2009). Sebbene siano già stati identificati un certo numero di alleli associati all’obesità ereditabili dai genitori (Guo et al., 2006), i fattori di esposizione ambientale dei genitori giocano una partita importante nel condizionare il fenotipo dei figli (Gluckman et al., 2009; Li et al., 2009), dando un potenziale contributo alla rapida crescita dell’obesità e del diabete. E l’obesità dei genitori può essere un elemento decisivo nel predisporre non solo i figli a obesità/diabete, ma anche le generazioni successive (trasmissione intergenerazionale). Pare però che il BMI paterno sia più decisivo nel predire i tratti metabolici dei figli rispetto al BMI della madre (Cell, 2015) Rompere il circolo vizioso sarà possibile, ma al prezzo di uno sforzo maggiore per chi ha ereditato un epigenoma sfavorevole frutto di un genitore o entrambi i genitori obesi/denutriti. EPIGENETICA
AL FEMMINILE
Anche le nonne paterne che hanno avuto accesso a messe di cibo nell’età prepuberale hanno influenzato negativamente il rischio di mortalità, ma solo nelle nipoti femmine (BMC Genet., 2014; Pembrey et al., 2006). Mentre le nipoti dei nonni paterni che sperimentarono la carestia in grembo vedevano ridotte le proprie attese di vita. Nell’intreccio tra carestia e abbondanza di cibo, vince la carestia: la scarsa disponibilità alimentare paterna e la buona disponibilità alimentare materna hanno generato figli con BASSO rischio cardiovascolare, secondo lo studio della rivista Annual Review of Genetics (1996). Tuttavia, vedremo più avanti che il ruolo positivo della denutrizione sulla prole è messo in discussione da studi autorevoli. Il ruolo cruciale dell’ambiente intrauterino Il combinato disposto di studi epidemiologici, clinici e su animali ha dimostrato che l’ambiente intrauterino influenza sia la crescita che lo sviluppo del feto e il futuro sviluppo di malattie da adulto. Ci sono precise finestre critiche durante lo sviluppo, spesso coincidenti con il periodo di rapida divisione cellulare, durante le quali uno stimolo o un insulto possono avere conseguenze di lungo periodo sulla salute di tessuti od organi. La disfunzione mitocondriale e lo stress ossidativo sono tra i primi problemi registrati in neonati che hanno subito una vita intrauterina di denutrizione e fornisce un elemento in più alla teoria dell’origine fetale della malattia adulta (Cell, 2015) L’EPIDEMIA
DI OBESITÀ, EPIGENETICA SU LARGA SCALA
Lo spostamento a livello mondiale verso il fenotipo obeso è accaduto in un periodo troppo breve -due generazioni- per chiamare in gioco anche (ma non solo) fattori di carattere genetico. Questo suggerisce che fattori di natura ambientale o epigenetico, quelli cioè che lavorano sui brevi periodi, possano avere giocato una parte determinante nella partita dell’obesità. Mentre c’è poco spazio al dubbio che lo stile alimentare occidentale con diete molto grasse combinati con una diminuzione generale dell’attività fisica diano un forte contributo al problema obesità, studi supportano l’idea che l’obesità possa iniziare nell’utero della madre. Ancor più importante è che l’obesità e le sue anomalie metaboliche si possono manifestare nella prole e nelle successive generazioni anche se la nutrizione postnatale è normale. Questa trasmissione dell’obesità, detta transgenerazionale, può avere luogo a causa di modificazioni dell’epigenoma. Modificazioni che, fortunatamente, sarebbero reversibili. Nella trasmissione epigenetica dell’obesità, le madri avrebbero un peso maggiore dei padri, secondo gli studi delle carestie olandese (Dutch, 1944-45) e cinese (1959-61). Lo storico studio di Overkalix (Svezia) condotto lungo tre generazioni ha invitato a non sottovalutare anche l’alimentazione degli uomini: padri che avevano mangiato in abbondanza nel periodo pre-adolescenziale avrebbero avuto figli e nipoti più esposti a mortalità per diabete (Int J Obes. 2015). L’EPIGENETICA
DELL’OBESITÀ SI ATTIVA ANCHE DURANTE LA
GRAVIDANZA.
Una
madre che ha seguito un’alimentazione molto
grassa durante la gravidanza può alterare
l’espressione genetica del figlio compromettendogli il
metabolismo dei grassi e degli zuccheri e la regolazione
dell’appetito (IOM, 2016). MA ANCHE PRIMA L’obesità pre-gravidanza e in gravidanza ha dimostrato di alzare l’infiammazione e lo stress ossidativo di diversi tessuti, tra cui la placenta. Una serie di studi hanno riportato che l’espressione di citochine, molecole pro-infiammatorie, e dei geni legati all’espressione dello stress ossidativo sono significativamente più elevati nella placenta di donne obese (Cell, 2015) Studi su animali suggeriscono che un alto stress ossidativo della madre obesa è direttamente legato allo sviluppo dell’obesità nei figli. Anche la malnutrizione materna prepara la tavola all’obesità dei figli  Lo studio sulla carestia olandese (The Dutch famine) del 1944/45 ha dato l’opportunità di determinare gli effetti della MALNUTRIZIONE PERINATALE sui bambini che in seguito sarebbero stati esposti ad abbondanza di cibo. La prole di madri esposte alla carestia (< 500 kcal) durante i primi due trimestri della gravidanza hanno generato figli sottopeso, ma in seguito colpiti da una maggiore incidenza di obesità rispetto alla popolazione generale. In particolare, neonati sottopeso che hanno recuperato peso rapidamente nei primi anni di vita hanno mostrato il più alto rischio di incorrere in obesità e sindrome metabolica da adulti. E’ stato osservato che proprio i bambini nati sottopeso a causa di una gravidanza segnata dalla denutrizione avessero la tendenza a guadagnare peso più velocemente degli altri durante il primo periodo postnatale, cosa che produce un aumento del grasso viscerale (Horm Res. 2006). Nello specifico, la ricerca pubblicata nel 2015 sull’International Journal of Obesity ci ha rivelato che gli adulti olandesi esposti alla carestia perinatale hanno mostrato un’ipometilazione del gene IGF-2 e un’ipermetilazione della leptina (più appetito) e del TNF (più infiammazione). Anche il diabete gestazionale o guadagnare peso in gravidanza hanno prodotto una ipermetilazione del gene della leptina. Dall’altro lato, L’IPERNUTRIZIONE FETALE porta con sé un fardello di effetti avversi sulla salute dei neonati. La gravidanza di una donna già obesa o che ha acquistato parecchio peso durante la gravidanza sono condizioni associate a neonati sovrappeso e che avranno un rischio maggiore di diventare adulti obesi e/o diabetici. Ecco spiegata l’epifania di una curva a U circa la relazione tra peso alla nascita e sviluppo di malattie metaboliche da adulti: nascere sottopeso o sovrappeso darà maggiori possibilità di diventare obesi da adulti (Int. J Obes., 2015). Iponutrizione e obesità in gravidanza rischiano di perpetuare le anomalie metaboliche all’infinito Sia la malnutrizione che l’obesità materne hanno mostrato di indurre anomalie metaboliche nella prima generazione (figli) e quando questo stato metabolico si perpetua fino alla gravidanza della figlia gli stessi problemi metabolici verranno trasmessi alla seconda generazione (figli dei figli) producendo un pericoloso circolo vizioso (Cell, 2015). Ecco perché in questi casi è ancora più urgente intervenire per rompere la catena di Sant’Antonio metabolica. I figli di madri iponutrite o obese pare subiscano modificazioni epigenetiche soprattutto a livello delle cellule di grasso, gli adipociti, grazie alla promozione dell’attività di un fattore “ingrassante” (promuove l’adipogenesi), il (PPAR) gamma, la cui attività si fa più pronunciata sia in condizione di iponutrizione che di ipernutrizione (Semin Reprod Med. 2011). Nei paesi occidentali non si parla più di carestie, ma potremmo fare un parallelo calzante con le madri ossessionate dal cibo e che “sopravvivono” cronicamente con alimentazioni attorno alle 800 kcal. Non è però tutto lineare come sembra. Le prove che coinvolgono un meccanismo epigenetico come potenziale mediatore dell’obesità vengono soprattutto da studi su animali, mentre quelli sugli umani sono limitati (Int. J Obes., 2015) È, sì, molto probabile che un ambiente uterino avverso produca delle modificazioni epigenetiche nel figlio, ma deve esser ancora appurato se queste modificazioni abbiano una rilevanza biologica (Cell, 2015). In ogni caso, sta diventando sempre più evidente che gli effetti di un ambiente uterino alterato possano passare alla terza generazione senza che questa abbia sperimentato l’ambiente uterino della prima generazione (Hum Reprod Update. 2014) CAMBIALI DA PAGARE
FINO ALLA TERZA GENERAZIONE
Queste modificazioni del DNA sulla base di
stress ambientali e senza coinvolgere la sequenza dei nucleotidi
(cioè senza mutazioni) sono EREDITABILI FINO ALLA TERZA
GENERAZIONE (EPIGENETICA TRANSGENERAZIONALE). I primi ad essere influenzati siamo noi, con il nostro stile di vita che modifica l’espressione del DNA. Tali modificazioni si fissano nelle nostre cellule somatiche, ma anche in quelle sessuali di nostro figlio che, a sua volta, trasmetterà la variazioni epigenetiche al proprio figlio. INFLUENZA EPIGENETICA PER TRE GENERAZIONI 1.
la madre (prima generazione)
2. il feto (seconda generazione) 3. le cellule riproduttive già presenti nel feto 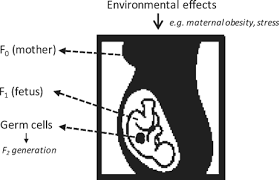  EPIGENETICA,
IL SUO RUOLO EVOLUTIVO
Il significato di questa
“staffetta epigenetica generazionale” è
quella di preparare i figli ad un terreno già sperimentato
dai padri perché si presume che le condizioni ambientali
sperimentate dai padri faranno da cornice anche alla vita dei figli.Insomma, l’epigenetica è una sorta di sistema ereditario soft (Mayr, 1980) che consente di adattarci alle veloci fluttuazioni ambientali legate a nutrizione, stress e agenti tossici. Si suppone che questo abbia favorito l’evoluzione (Colaneri et al., 2013, House, 2014, Hunter, 2008, Jablonka, 2013,Mazzio and Soliman, 2014, Mendizabal et al., 2014, Rebollo et al., 2010, Richards, 2006 and Varriale, 2014). Tuttavia ha mostrato qualche effetto collaterale: carestie, malnutrizioni, un nuovo patogeno, un nuovo agente chimico o inquinante, a cui si è esposti durante particolari fasi della vita possono incrementare il rischio di sviluppare malattie o disordini metabolici nelle successive generazioni L’epigenoma è un elemento plastico, dinamico che muta in risposta all’alimentazione, all’esercizio fisico, alla perdita o all’acquisto di peso, oltre ad altri fattori ambientali (Int J Obes., 2015) Siccome le modificazioni epigenetiche possono essere reversibili (Int J Obes., 2015), capire come i meccanismi epigenetici contribuiscano alla trasmissione transgenerazionale di problemi come l’obesità e la sindrome metabolica è cruciale per sviluppare strategie di intervento precoce. Ricordiamo che l’eredità epigenetica può interessare sia le cellule somatiche che la linea germinale maschile che femminile EPIGENETICA e RANE
 Per chiarire l’utilità dell’epigenetica sul breve periodo ci viene in aiuto uno studio sul ruolo dell’ambiente e il tipo di sviluppo imboccato dai girini. Prelevando delle ovature della stessa femmina e dividendole in frazioni di 50 uova le si è immerse in una serie di vasche artificiali con condizioni ambientali DIVERSE: a) vasche senza pesci predatori b) vasche con pesci predatori liberi c) con pesci predatori separati dalle uova da una rete Si sono allevati i girini che, pur figli della stessa madre (stesso DNA), hanno sviluppato caratteristiche fisiche (fenotipo) molto diverse tra loro. I girini cresciuti in un ambiente ostile (presenza di pesci predatori, sia liberi che separati da una rete) erano TUTTI più veloci, più muscolosi, con una ridotta aspettativa di vita e un’età riproduttiva anticipata. L’opposto di quanto osservato tra i girini cresciuti in un ambiente senza predatori: più lenti, ma più longevi e con un’età riproduttiva spostata più avanti COSA CI
INSEGNA L’EPIGENETICA?
Che la costanza di uno stile di vita sano e regolare -e non abborracciare uno-due mesi l’anno di attività fisica- ci potrebbero aiutare a tenere a bada quei tratti di DNA impostati sulla espressione di malattie metaboliche, ma anche di certi tumori senza componenti ereditarie o legati all’invecchiamento. Sì, perché condurre una vita regolare e attiva “convince il nostro organismo” che possiamo funzionare in modo efficiente ancora per molti giri di calendario con una posticipazione della fine dell’età riproduttiva. L’EFFICIENZA IN CHIAVE RIPRODUTTIVA, per noi che siamo “macchine per la replicazione del DNA”, è un potente segnale epigenetico che ci regala un bonus di vita. Non solo, l’adozione di stili di vita e abitudini alimentari corrette migliora certamente la nostra vita e con tutta probabilità offrirà una chance di salute in più ai nostri figli e ai nostri nipoti. La sapranno sfruttare? A questo punto la palla passa a loro. QUANTO CONTANO
L’AMBIENTE E GLI STILI DI VITA
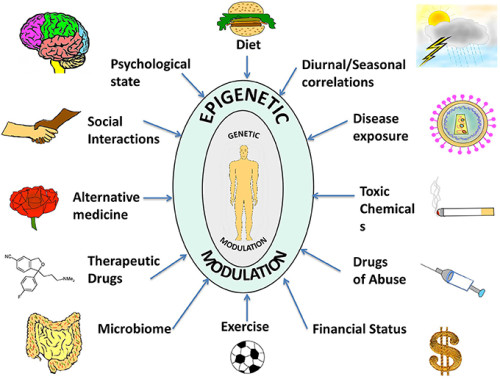 La modulazione epigenetica del DNA è influenzata da tantissimi fattori ambientali, alcuni dei quali insospettabili. Al netto di studi che confermino senza ombra di dubbio la loro influenza, è sempre buona abitudine non fare terrorismo ricordando che sono sempre le dosi e i tempi di esposizione a fare la differenza. 1. malnutrizione, come la carestia (Heijmans et al., 2008) o l’ipernutrizione (Pembrey et al., 2006) 2. diete ipo-proteiche (Carone et al., 2010) 3. carenze vitaminiche o di micronutrienti (Mejos et al., 2013) 4. diete ad alto tenore di grassi (Ng et al., 2010 and Wei et al., 2014) 5. sostanze tossiche derivate dalla plastica (Manikkam et al., 2013) 6. obesità (Soubry et al., 2013b) 7. fumo (Northstone et al., 2014) 8. stress (Gapp et al., 2014 and Rodgers et al., 2013), 9. solventi e pitture (Reid et al., 2011 and Wilkins and Sinks, 1984) 10. pesticidi (Skinner et al., 2013) 11. radiazioni ionizzanti (Gardner et al., 1990 and Koturbash et al., 2006) 12. guerra (Ngo et al., 2010) 13. stato psicologico 14. interazioni sociali 15. farmaci 16. microbioma intestinale 17. sport 18. status economico 19. abuso di droghe 20. condizioni meteorologiche di un ambiente Cancro, diabete, obesità, malattie croniche non-genetiche e disordini mentali paiono subire una influenza dall’epigenetica (van Os and Selten, 1998; Barker, 2004; Yajnik, 2004; Painter et al., 2005; St Clair et al., 2005; Gluckman et al., 2007; Mileva et al., 2014) L’EPIGENETICA NEL FUTURO 1. Identificare i marker epigenetici nei gameti (spermatozoi e uova) ci aiuterà a individuare il livello di predisposizione dei nostri figli per certe malattie non-genetiche 2. Individuare quei momenti, durante la formazione delle cellule germinali, particolarmente sensibili ai disturbi ambientali Il terzo è quello di breve termine e che ci riguarda più da vicino: MODIFICARE IL NOSTRO STILE DI VITA. Interventi alimentari e sportivi su uomini obesi prima del concepimento hanno mostrato di migliorare l’integrità del DNA spermatico (Ann Nutr Metab., 2014) Se non per noi, facciamolo per i nostri discendenti. L’ULTIMA
PAROLA la lascio al maggiore esperto di epigenetica del nostro paese,
il prof. Mauro Mandrioli, dell’Università di
Modena-Reggio e che ho il piacere di ospitare in questo spazio:
“Prima di tutto è importante sottolineare che le evidenze di una trasmissione ereditaria di modificazioni epigenetiche sono ad oggi presenti per pochissimi caratteri e in pochi modelli sperimentali per cui questo rappresenta un ambito di ricerca interessante, ma certamente siamo lontani dal fatto di avere chiaro come funzioni questo processo e quanto sia diffuso. Sulla base delle poche pubblicazioni disponibili e accreditate, in modelli animali può esservi sia una trasmissione paterna che materna e si deve distinguere quello che è ereditario da quello che è transgenerazionale. Nel secondo caso un farmaco o più in generale una molecola può, durante la gravidanza, alterare le modificazioni epigenetiche sia della madre che del feto ma questa non è eredità epigenetica, quanto effetto di una sostanza su due generazioni per azione diretta. Il concetto di epiallele è sicuramente interessante anche da un punto di vista evolutivo però in questa fase è bene essere prudenti per non “vendere” qualche cosa che non conosciamo ancora. Di sicuro però ci sono tantissimi caratteri che non sono affatto influenzati da variazioni epigenetiche guidate dall’ambiente per cui potremmo essere di fronte ad una interessante novità ma limitata ad alcuni caratteri.” E il ruolo dell’alimentazione nella trasmissione epigenetica? Prosegue il prof. Mandrioli: “L’alimentazione si rapporta con il nostro genoma, epigenoma e microbioma e l’obesità ad esempio può derivare da ciascuna di questi elementi per cui lo stesso stimolo ha effetti diversi per motivi diversi. Alcuni dati pubblicati suggeriscono che il metabolismo dei genitori lasci una firma epigenetica nei gameti per anticipare la comparsa nei figli di un metabolismo adeguato alle condizioni alimentari sperimentate dai genitori. In ambienti costanti questo è un vantaggio, mentre una alternanza di generazioni povere o ricche di cibo questo è uno svantaggio… anche in questo caso però è necessario essere cauti perché le evidenze sono ancora poche.” CONCLUSIONI
Gli studi tradizionali si sono concentrati
sul DNA come portatore di informazioni ereditabili che passano il
fenotipo (quello che si vede della persona e la sua fisiologia) dai
genitori ai figli. Prove sempre maggiori suggeriscono che un tipo di informazione, indipendente dalla sequenza del DNA, detta informazione epigenetica, può essere elaborata in brevissimo tempo e trasmessa a figli e nipoti. L’epigenetica ha un ruolo critico nel modulare il potenziale dell’informazione immagazzinata nel DNA e dare luogo a un programma trasmesso tutto “in chiaro”, può “criptarne” una parte, può “sfocare” o “accentuare la luminosità” di alcuni fotogrammi. L’epigenetica è un campo di ricerca in gran parte inesplorato e molto è ancora da scoprire. Tante patologie delle quali non si conosce la causa potrebbero rispondere a meccanismi epigenetici (diabete di tipo II, Alzheimer, autismo…) così come molte forme tumorali e la stessa obesità. Fermo restando che spesso ci troviamo di fronte a problemi dal contributo multifattoriale. È dunque prematuro quantificare il peso attribuibile alla genetica, all’epigenetica e allo stile di vita. Attualmente le ricerche sull’epigenetica mostrano una possibilità: le cattive abitudini non punirebbero soltanto chi le pratica, ma allungherebbero il loro cono d’ombra fino alla terza generazione. Fermo restando che ci sono tantissimi caratteri che non sono affatto influenzati da variazioni epigenetiche guidate dall’ambiente. Tra i tratti probabilmente influenzati dall’epigenetica c’è l’obesità, quello più vicino al nostro interesse. Figli e nipoti rischiano di affacciarsi alla vita con uno svantaggio: scontare le colpe comportamentali dei nonni e dei padri/madri. Oppure potrebbero sfruttare l’onda lunga dei benefici epigenetici maturati dai nonni o dai padri e madri virtuosi. Se quanto detto e promesso dall’epigenetica trovasse conferma, il vecchio adagio che accarezza le buone abitudini sportive e alimentari verrebbe rivalutato nell’enfasi delle sue conseguenze sui discendenti. BIBLIOGRAFIA Hum Fertil (Camb). 2010 Male-line transgenerational responses in humans. Pembrey ME. J Med Genet. 2014 Human transgenerational responses to early-life experience: potential impact on development, health and biomedical research. Pembrey M, Saffery R, Bygren LO; Network in Epigenetic Epidemiology; Network in Epigenetic Epidemiology. Hum Reprod Update. 2015 Environmental epigenetic inheritance through gametes and implications for human reproduction. Wei Y, Schatten H, Sun QY. Prog Biophys Mol Biol. 2015 Epigenetic inheritance and evolution: A paternal perspective on dietary influences. Soubry A. Ann Nutr Metab. 2014 Paternal obesity, interventions, and mechanistic pathways to impaired health in offspring. McPherson NO, Fullston T, Aitken RJ, Lane M. Eur J Hum Genet. 2002 Cardiovascular and diabetes mortality determined by nutrition during parents' and grandparents' slow growth period. Kaati G, Bygren LO, Edvinsson S. BMC Genet. 2014 Change in paternal grandmothers' early food supply influenced cardiovascular mortality of the female grandchildren. Bygren LO, Tinghög P, Carstensen J, Edvinsson S, Kaati G, Pembrey ME, Sjöström M. Proc Natl Acad Sci U S A. 2015 Transgenerational epigenetic programming via sperm microRNA recapitulates effects of paternal stress. Rodgers AB, Morgan CP, Leu NA, Bale TL. Cell. 2015 I'm eating for two: parental dietary effects on offspring metabolism. Rando OJ, Simmons RA. Int J Obes (Lond). 2015 Epigenomics, gestational programming and risk of metabolic syndrome. Desai M, Jellyman JK, Ross MG. Horm Res. 2006 Size at birth, postnatal growth and risk of obesity. Semin Reprod Med. 2011 Fetal programming of adipose tissue: effects of intrauterine growth restriction and maternal obesity/high-fat diet. Desai M, Ross MG. Obesity in the Early Childhood Years: State of the Science and Implementation of Promising Solutions—Workshop in Brief Atti Convention ISSA, Bellaria 2016 Fitness&Sport n. 2-3, 2016 |